
华东医药股份有限公司
-
中美华东医药品牌宣传年度服务
策划创意,原创插画,海报设计,药品包装设计、折页设计

中生复诺健生物科技(上海)有限公司
-
中国生物疫苗包装设计
产品包装设计,材质工艺建议

浙江金康医药有限公司
-
康恩贝制药年度服,全案赋能,石特大健康与浙江金康医药年度合作硕果累累
医药品牌全案设计、药品包装升级、OTC产品手册设计、中医药产品策划、产品线形象整合、康恩贝集团合作案例、医药营销物料设计、品牌视觉焕新

太极集团四川绵阳制药有限公司
-
老药新装,价值重塑:石特大健康助力太极绵阳制药产品矩阵全面升级
医药包装设计,中成药品牌升级,OTC产品手册设计,药品礼盒设计,太极集团包装设计,品牌全案设计

江苏申命医疗科技有限公司
-
医疗器械全新产品策划设计
包装策划,结构设计,包装设计,材质工艺建议,打样成品制作

人福普克药业(武汉)有限公司
-
人福普克药业出口系列包装设计
系列规划,系列产品设计,印刷制作工艺建议

浙江华海药业股份有限公司
-
华海药业全系列包装设计升级规范
品牌定位,产品规划,包装设计

浙江上药九洲生物制药有限公司
-
上海医药单品包装设计,仿制药一致性评价
产品包装设计,复杂说明书设计,材质工艺建议

浙江九洲生物医药有限公司
-
九洲药业包装系列化打造设计
系列策划,包装设计,宣传设计

江苏福囍医药科技有限公司
-
品牌资产变现:福囍医药多品类产品包装的体系化落地设计
品牌包装落地, 药品系列化包装, OTC产品包装, 保健品包装设计, 品牌视觉应用, 葫芦符号设计, 医药品牌全案设计公司
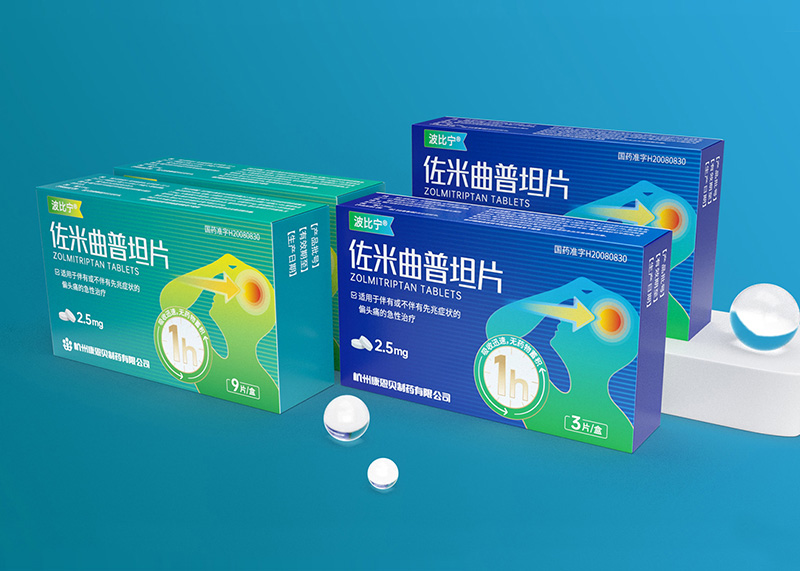
浙江金康医药有限公司
-
佐米曲普坦片药品包装升级设计
佐米曲普坦片药品包装设计

包头东宝生物技术股份有限公司
-
东宝生物子品牌产品牛骨胶原肽粉包装设计
品牌定位,产品规划,包装设计
化学药品和治疗用生物制品说明书规范细则(修订稿)
“ 核准和修改日期”
核准日期为国家药品监督管理局批准该药品注册的时间。修改日期为此后历次修改的时间。
核准和修改日期应当印制在说明书首页左上角。修改日期位于核准日期下方,按时间顺序逐行书写。
“ 特殊药品、外用药品标识”
麻醉药品、精神药品、医疗用毒性药品、放射性药品和外用药品等专用标识在说明书首页右上方标注。
“ 说明书标题”
“XXX 说明书” 中的“XXX” 是指该药品的通用名称。
“ 请仔细阅读说明书并在医师指导下使用”
该内容必须标注,并印制在说明书标题下方。
“ 警示语”
是指对药品严重不良反应及其潜在的安全性问题的警告,还可以包括药品禁忌、注意事项及剂量过量等需提示用药人群特别注意的事项。
有该方面内容的,应当在说明书标题下以醒目的黑体字注明。无该方面内容的,不列该项。
【药品名称】
按下列顺序列出:
通用名称:中国药典收载的品种,其通用名称应当与药典一致;药典未收载的品种,其名称应当符合药品通用名称命名原则。
商品名称:未批准使用商品名称的药品不列该项。
英文名称:无英文名称的药品不列该项。
汉语拼音:
【成份】
1 、列出活性成份的化学名称、化学结构式、分子式、分子量。并按下列方式书写:
化学名称:
化学结构式:
分子式:
分子量:
2 、复方制剂可以不列出每个活性成份化学名称、化学结构式、分子式、分子量内容。本项可以表达为“ 本品为复方制剂,其组份为:” 。组份按一个制剂单位(如每片、粒、支、瓶等)分别列出所含的全部活性成份及其量。
3 、多组份或者化学结构尚不明确的化学药品或者治疗用生物制品,应当列出主要成份名称,简述活性成份来源。
4 、辅料:处方中含有可能引起严重不良反应的辅料的,该项下应当列出该辅料名称。
5 、注射剂应当列出全部辅料名称。
6 、冻干制品的溶媒。
【性状】
包括药品的外观、臭、味、溶解度以及物理常数等。
【规格】
指每支、每片或其他每一单位制剂中含有主药(或效价)的重量或含量或装量。生物制品应标明每支(瓶)有效成分的效价(或含量及效价)及装量(或冻干制剂的复溶后体积)。
表示方法一般按照中国药典要求规范书写,有两种以上规格的应当分别列出。
【适应症】
应当根据该药品的用途,采用准确的表述方式,明确用于预防、治疗、诊断、缓解或者辅助治疗某种疾病(状态)或者症状。
【用法用量】
应当包括用法和用量两部分。需按疗程用药或者规定用药期限的,必须注明疗程、期限。
应当详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。
用法上有特殊要求的,应当按实际情况详细说明。
【禁忌】
应当列出禁止应用该药品的人群或者疾病情况。
【警告和注意事项】
在【警告和注意事项】项下,必须包括对整个说明书中最有临床意义安全性问题的简要总结,这些信息会影响是否处方给药的决定、为确保安全使用药物对患者进行监测的建议,以及可采取的预防或减轻损害的措施。
应列出使用时必须注意的问题,包括需要慎用的情况(如肝、肾功能的问题),影响药物疗效的因素(如食物、烟、酒),用药过程中需观察的情况(如过敏反应,定期检查血象、肝功、肾功)及用药对于临床检验的影响等。
滥用或者药物依赖性内容可以在该项目下列出。
【不良反应】
应当实事求是地详细列出该药品不良反应。并按不良反应的严重程度、发生的频率或症状的系统性列出。
【药物相互作用】
列出与该药物产生相互作用的药物或者药物类别,并说明相互作用的结果及合并用药的注意事项。
可简单描述无相互作用的研究药物。
未进行药物相互作用研究且无可靠参考文献的,应当在该部分予以说明。
【孕妇及哺乳期妇女用药】
着重说明该药品对妊娠、分娩及哺乳期母婴的影响,并写明可否应用本品及用药注意事项。
未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【儿童用药】
主要包括儿童由于生长发育的关系而对于该药品在药理、毒理或药代动力学方面与成人的差异,并写明可否应用本品及用药注意事项。

 0571-88685587
0571-88685587 15605889708
15605889708