
华东医药股份有限公司
-
中美华东医药品牌宣传年度服务
策划创意,原创插画,海报设计,药品包装设计、折页设计

中生复诺健生物科技(上海)有限公司
-
中国生物疫苗包装设计
产品包装设计,材质工艺建议

浙江金康医药有限公司
-
康恩贝制药年度服,全案赋能,石特大健康与浙江金康医药年度合作硕果累累
医药品牌全案设计、药品包装升级、OTC产品手册设计、中医药产品策划、产品线形象整合、康恩贝集团合作案例、医药营销物料设计、品牌视觉焕新

太极集团四川绵阳制药有限公司
-
老药新装,价值重塑:石特大健康助力太极绵阳制药产品矩阵全面升级
医药包装设计,中成药品牌升级,OTC产品手册设计,药品礼盒设计,太极集团包装设计,品牌全案设计

江苏申命医疗科技有限公司
-
医疗器械全新产品策划设计
包装策划,结构设计,包装设计,材质工艺建议,打样成品制作

人福普克药业(武汉)有限公司
-
人福普克药业出口系列包装设计
系列规划,系列产品设计,印刷制作工艺建议

浙江华海药业股份有限公司
-
华海药业全系列包装设计升级规范
品牌定位,产品规划,包装设计

浙江上药九洲生物制药有限公司
-
上海医药单品包装设计,仿制药一致性评价
产品包装设计,复杂说明书设计,材质工艺建议

浙江九洲生物医药有限公司
-
九洲药业包装系列化打造设计
系列策划,包装设计,宣传设计

江苏福囍医药科技有限公司
-
品牌资产变现:福囍医药多品类产品包装的体系化落地设计
品牌包装落地, 药品系列化包装, OTC产品包装, 保健品包装设计, 品牌视觉应用, 葫芦符号设计, 医药品牌全案设计公司
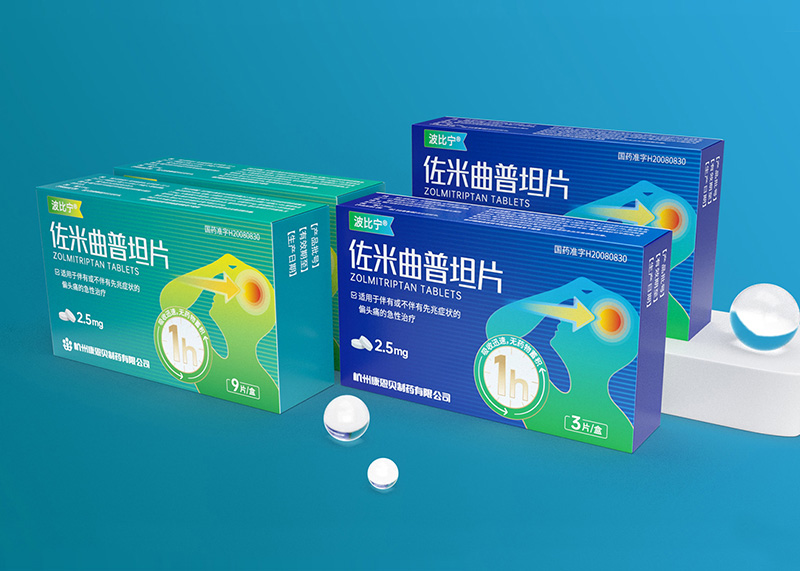
浙江金康医药有限公司
-
佐米曲普坦片药品包装升级设计
佐米曲普坦片药品包装设计

包头东宝生物技术股份有限公司
-
东宝生物子品牌产品牛骨胶原肽粉包装设计
品牌定位,产品规划,包装设计
【原创】百问百答系列4期—— 一致性评价
mp.weixin.qq.com/s/bRdFHKv4GAfIzEEWLnGUIQ
01 社群精选问答
问题1:现在注射剂一致性评价在国家局网上申报系统里,是按补充申请还是一致性评价申请申报?
回答:一致性评价。
问题2:一致性评价时申请BE实验时需要提交稳定性资料吗?处方工艺有变更和处方工艺无变更递交资料时有什么不一样吗?
回答:一致性评价时申请BE实验时,BE试验备案信息表里没有要求提交稳定性资料,仿制药BE试验备案需要至少中试规模三批稳定性数据(包括BE批),具体的可以看看备案信息表里的要求。三个月的稳定性数据。处方工艺有变更和处方工艺无变更递交资料时,模块一样,具体内容不一样,无变更的填写原处方工艺,有变更的填写新的处方工艺。
问题3:我们一致性评价品种,加速试验数据总杂大概是原研品种的2~3倍,但是在质量标准范围内,这种情况可以接受吗?还是必须所有的数据都不劣于原研?
回答:在质量标准范围内,就叫质量一致/不劣于。按质量标准讲,是可以接受的。但你们内部得评估是否由于包材较原研差,导致的这种现象。还需要评估自制制剂和参比制剂加速试验时杂质变化的趋势是否相同,以考察二者稳定性的差异。
问题4:一致性评价时,对一个产品,其标准已收载于药典,但参比制剂为进口产品,那一致性评价时的标准应该参照哪个?药典还是进口标准?因为药典标准通常会低于进口标准,尤其杂质控制。
回答:仿制药二条红线:
——质量标准高于或等于你能找到的任何标准,尤其是法定标准;
——实测数据高于或等于RLD;任何踩这两条红线的情况,都属于重大风险,需要十分慎重。药典标准和进口标准,一条条对比,谁高就用谁。如果限度一样但方法不同,还得证明谁方法更好。
问题5:国内什么情况下“新注册分类化药仿制药视同一致性评价”?
回答:六、按新注册分类后批准的仿制药和新注册分类申报批准上市的仿制药是否都视为通过一致性评价。答:根据总局2015年第230号文规定,新注册分类实施后申报并批准上市的仿制药将是按与原研药质量和疗效一致的原则进行受理和审评审批。新注册分类实施前受理并在实施后批准的仿制药,如企业选择按原规定进行审评审批,则需在药品批准上市3年内需按照国发〔2015〕44号文件规定进行质量和疗效一致性评价。仿制药质量和疗效一致性评价工作政策问答。
问题6:一致性评价批准后多久还可以用旧包装?
回答:这个正常情况是立即执行的,你这个需要跟地方省局申请也是可以,至于多久就看你沟通情况了。法规没有明确规定时间,批件里面是照新批准的说明书,标准和工艺执行。一致性评价获批后需要在国家局网上办事大厅的业务系统中进行备案,备案日期之后生产的产品 包装按照备案执行。但获批到备案时间没有明确规定。
问题7:一致性评价可以没有参比制剂吗?
回答:有那种临床价值明确但不推荐参比制剂的, 出了药学研究指导意见那种可以没有。基本都有的。名字就是质量和疗效一致性评价,没参比就没标杆,没法评价。
问题8:国家尚未推荐参比的口固制剂,可否进行一致性评价?可用注射剂作为参比做一致性评价吗?
回答:基于风险,先进行参比备案,国家批准了再进行一致性,不可以用注射剂做参比制剂。
问题9:一致性评价中,原研产品需要一并做稳定性吗?一般原研产品要几批,检测点可以跳检吗?
回答:质量对比研究一般原研要3批,稳定性原研一批即可。原研要按指导原则来,稳定的品种是不需要的,一般都是放进去对比一下第六个月杂质谱,不稳定的品种就需要了,重点在看趋势,可以看一下华海那个带条件批准的品种。
问题10:一个品种未过一致性评价,选择增加规格,对增加规格的品种进行一致性评价,那增加规格和一致性评价可以同时申报吗?
回答:按一致性研究,增的规格处方工艺与原规格不一样,BE要重做。
问题11:进口仿制药一致性评价,不改变原辅料来源的,原辅料没有登记,也无法在资料中提供登记资料,是否可以?
回答:可不登记,但必须按要求提供登记资料。参考以下公告:CFDA 总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号) 290190715,国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)
问题12:一致性评价品种,原品种说明书和原研的有出入,以哪个为准来确定终稿说明书呢?
回答:按照原研的。说明书会有审评中心老师找你沟通的。若有一致性评价已经过了的厂家,可以从CDE找到他们的说明书,跟他们一样即可。根据以上原则,先交上去。
问题13:我们公司要做一个注射剂一致性评价,但同时想增加两个规格,这怎么申报?没有批文,就是增加原研或参比制剂已有的规格?
回答:一致性评价申请按品种管理,开通新增药品规格的补充申请直接申报一致性评价途径。为了防止规格滥用,新增加的药品规格需符合临床合理用法用量范围,且与原研(参比制剂)一致。
问题14:一致性评价标识印在标签小盒有什么尺寸限制或要求吗?
回答:20170825总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)。
问题15:一致性评价,显示在药审中心审评状态,目前进度是完成生产和研发现场考核后并已经完成第一次发补。想在审评中递交变更上市持有人申请,持有人从子公司变成母公司。这种情形是不是也适用于上市后变更管理办法中的持有人变更管理?
回答:审评中可以对申请人名称变更可以书面告知CDE,并提交相关证明性材料,审评中变更持有人应该是不可以。获批后变更持有人的路径,就参考上市后变更管理办法。
问题16:《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中要求“注射剂中辅料种类和用量通常应与参比制剂(RLD)相同。辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%—105%”,那么注射剂一致性评价时需要将各辅料的含量检测项定入最终的质量标准中吗?
回答1:这个跟辅料含量没有关系,你处方比例一致就行了。应该是处方中的加入量,在制剂的成品质量标准中是不定入的。回答2 :参比制剂解析时可以测定各辅料含量,然后自制制剂处方研究时参考。
问题17:按照新分类上报的制剂,批准后,是否可视为已通过一致性评价?还是后续要做一致性评价的?
回答:视为通过一致性评价。六、按新注册分类后批准的仿制药和新注册分类申报批准上市的仿制药是否都视为通过一致性评价。答:根据总局2015年第230号文规定,新注册分类实施后申报并批准上市的仿制药将是按与原研药质量和疗效一致的原则进行受理和审评审批。新注册分类实施前受理并在实施后批准的仿制药,如企业选择按原规定进行审评审批,则需在药品批准上市3年内需按照国发〔2015〕44号文件规定进行质量和疗效一致性评价。《仿制药质量和疗效一致性评价工作政策问答》。
问题18:注射剂需要做BE吗?已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)是有提到需要做。
回答:一般注射剂免BE,对于特殊注射剂,需要做BE,与普通注射剂相比,特殊注射剂的质量及其活性成分的体内行为受处方和工艺的影响较大,可能进一步影响制剂在体内的安全性和有效性,首先开展受试制剂与参比制剂药学及非临床的比较研究,然后进行人体生物等效性研究,必要时开展进一步的临床研究。对于FDA或EMA已公布指导原则的特定注射剂品种,建议参照FDA或EMA技术要求开展与参比制剂的对比研究。
问题19:一致性评价的申报资料还是按着2016年的120号文件对吗?新注册分类申报的,就是按M4格式要求提交?
回答:一致性评价品种按照120文提交申报资料,按补充申请提交。新注册分类的按照M4格式要求。
问题20:一致性评价是不需要经过NMPA最后批准,由CDE直接行政审批的是吗?
回答:所有的补充申请都是CDE批准,不需要送注册司发件,都是CDE直接发批件
问题21:我们有个口服溶液剂已按照一致性评价的要求完成了相关研究工作,是否就是按照补充申请途径申报呢?能拿到过评的批准件吗?
回答:现在一致性评价就口服固体制剂和注射剂,按照补充申请申报过评可以视同通过一致性。
问题22:仿制药申请视同一致性评价,在哪个法规里面有规定啊?
回答:NMPA公告2017年第100号。
问题23:一致性评价的时候可以把原辅包的供应商一起变了吗?
回答:可以。
问题24:一致性评价杂质部分是只写已知杂质吗?和原研杂质比对是放这里吗?
回答:全面的杂质分析都需要写的,研究中发现的新的降解杂质,以及各国药典中对API和制剂的杂质要求及质量对比都要有,写在8.5.5章节。
问题25:按照一致性评价要求做滴眼液,原研防腐剂用量能够查到,检测也是0.03%,自制品和参比抑菌效力都没通过,因此将防腐剂用量筛选做完后选择了0.06%。相当于已经超过了±5%的要求,CDE这边虽然暂时没有对眼科药出台具体的指导原则,但是按照《眼科仿制药质量和疗效一致性评价的基本思路 》这篇文章来看,CDE暂时的思路还是参考FDA那边的,所以变更了辅料的用量(也就是Q2不同),原则上是应该做BE而不是安全性评价(刺激性实验属于安全性评价的一部分内容,本来在ANDA时就需要做的,能不能拿安评实验的一部分来代替BE?(这个可能不合理)如果不做BE,有没有不批准的风险?
回答:眼科的BE相当于做个验证性临床了,成本还是很高的。超过了Q2的要求,理论上市需要做BE的(溶液型滴眼液),如果不做BE,需要证明差异对安全性有效性无影响,这个就不好证明了,要结合适应症来分析。通常来说原研产品的质量可控性已经经过FDA的审核,没有问题的,抑菌效力不合格是不是方法有问题,或者要求太严格了。给个建议,日本有用动物来验证差异的,但是FDA没见过这样的操作,CDE不一定会认可,如果是国内首家上市,认为这个差异可以接受,后续通过验证性临床来证明安全性有效性。
问题26:已过一致性评价的品种新增规格,是按照一致性评价申报还是直接按照重大变更的补充申请报?
回答:可以按照一致性评价申报。
问题27:一致性评价申请是否可以关联变更生产场地?有2个工厂,批文的生产地址在A工厂,一致性评价直接在B工厂进行,是否可以?
回答:可以,甚至可以变更规格附带申请一致性评价。这是两个申请事项。一致性评价申请是国家局补充申请形式,根据生产监督管理办法变更生产场地属于省局的监管范畴。
问题28:我公司现在仅有某品种10mg规格,请问这时候可以做一个20mg规格申报一致性评价,同时豁免10mg规格的品种,就是增加一个规格来申报一致性评价。是否可以这种操作?
回答:可以,能否豁免10mg,需要根据两个规格的处方是否为等比例变化,而且体外溶出相似。

问题29:我们有个注射剂品种大规格已经通过一致性评价获得批件后,增加规格按一致性评价通道走的,现在受理老师让我们撤回按补充申请走,说要同时申报才按一致性评价走,想知道有没有和我一样情况的?
回答:我们单独申报后,可以按照一致性评价。
问题30:一致性评价是做完验证三批,就可以直接上BE了是吗?有稳定性数据6个月就可以申报了对吗?具体是哪个法规出来的?国家药监局药审中心关于发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等3个文件的通告(2020年第2号)是这个吗?
回答1: BE备案表和一致性评价申报资料。回答2: 一致性评价产品是生产完就可以立即进行be备案,3、4类产品,生产完后有三个月稳定性数据才能去BE备案。
问题31:新增加规格目前能不能按照4类仿制药申报呢?或者按补充申请报的话目前会不会视为通过一致性评价呢?
回答1:

回答2:我们不久前刚提交了一个通过一致性评价通道增加规格的补充申请,新增规格有参比制剂的话,受理是没问题的。我们是注射液,参照注射液那个一致性评价要求来的。
问题32:我们的是滴眼剂,滴眼剂现在还没有出来一致性评价的法规,不知道这么操作行不行。
回答:可以先和CDE沟通,不过没有法规,你们这种申报会不会不受理。
问题33:仿制药一致性评价申报资料要求应该继续参照2016年80号文还是应该参照新的《化学药品注册受理审查指南(试行)》(2020年第10号)?
回答:仿制药一致性评价申报资料要求应该继续参照2016年120号文。
问题34:关于注射剂一致性评价的问题. 注射剂一致性评价产品为了和参比制剂的处方用量一致,将其中一种辅料的用量微调,其他不变,和参比制剂保持一致,这样需要做非临床研究么?比如局部耐受性的刺激性、耐受性、溶血性等。
回答:如果再评价产品的处方工艺均发生了变化,需要进行开展过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验。
问题35:A胶囊一致性评价首家过评时间为2019年11月1日;A片一致性评价过评时间为2020年8月10日,A分散片一致性评价过评时间为2021年6月8日。我司产品为A分散片,要和哪个时间为起始的3年期限必须完成一致性评价?同一成分,剂型不同也属于不同品种?
回答:应该以2019年11月1日这个时间为起始的3年期限必须完成一致性评价;2018.12.28《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读八、仿制药评价时限如何调整?
答:化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成评价。考虑到药品临床需求存在地域性和时效性等特点,为确保市场供应和人民群众用药可及性,企业未能按上述要求完成评价的,经评估认为属于临床必需、市场短缺的品种,可向所在地省级药监部门提出延期评价申请,说明理由并提供评估报告,省级药监部门会同卫生行政部门组织研究论证,经研究认定为临床必需、市场短缺品种的,可适当予以延期,原则上不超过5年。同时,对同意延期的品种,省级药监部门会同相关部门要继续指导、监督并支持企业开展评价工作。届时仍未完成的,药监部门不予批准其药品再注册申请。这里强调的是品种不是剂型。就像集采名单同一个品种下面有不同的剂型
问题36:我们有一个进口产品还没有申报一致性评价的补充申请,但是这个产品有一家已经通过了一致性评价了。我们的注册证马上要到期了,现在要开始报,再注册申请了,如果这样的话,CDE能批这个再注册的申请吗?
回答:请参考 2018年12月28日发布的《关于仿制药质量和疗效一致性评价有关事项的公告》政策解读,化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成评价。考虑到药品临床需求存在地域性和时效性等特点,为确保市场供应和人民群众用药可及性,企业未能按上述要求完成评价的,经评估认为属于临床必需、市场短缺的品种,可向所在地省级药监部门提出延期评价申请,说明理由并提供评估报告,省级药监部门会同卫生行政部门组织研究论证,经研究认定为临床必需、市场短缺品种的,可适当予以延期,原则上不超过5年。同时,对同意延期的品种,省级药监部门会同相关部门要继续指导、监督并支持企业开展评价工作。届时仍未完成的,药监部门不予批准其药品再注册申请。
问题37:新仿制药,增加规格,通过审评后,可以直接视同通过一致性评价吗?申请表和资料中需要特殊备注吗?
回答:根据《药品注册管理办法》及其相关规定,增加药品规格为补充申请事项。增加规格,通过审评后,可以直接视同通过一致性评价,可以参考华润赛科药业有限责任公司左乙拉西坦片(0.25g)。

 0571-88685587
0571-88685587 15605889708
15605889708